Autorský kolektiv:
Mgr. Hana Polzerová,
Ing. Marie Greplová,
Ing. Jaroslava Domkářová, Ph.D., MBA
1 Cíl metodiky
Oomyceta Phytophthora infestans způsobuje v celosvětovém měřítku nejzávažnější chorobu bramboru (Solanum tuberosum). Odhaduje se, že až 3,5 miliard dolarů ročně činí náklady spojené s ochranou (Wang a kol. 2008). Zařazení rezistentních druhů do šlechtitelských programů je cestou ke snížení nákladů i zátěže životního prostředí. Příkladem zdrojů rezistence jsou mexické druhy S. pinnatisectum (Chen a kol. 2003, Ramon a Hanneman 2002), S. bulbocastanum (Chen a kol. 2003, Szczerbakowa a kol. 2003, Helgeson a kol. 1998) a andské druhy S. berthaultii (Rauscher a kol. 2006), S. microdontum (Sandbrink a kol. 2000), S. mochiquense (Smilde a kol. 2005) a S. paucissectum (Villamon a kol. 2005). Rezistence nesená těmito druhy je klasifikovaná jako rasově specifická, rasově nespecifická a „non-host“ rezistence (Agrios 1997). Důkaz přenosu rezistence je zásadním krokem ve šlechtění a je předpokladem následné selekce. K tomuto účelu slouží polní test (Shaner a Finney 1977, Fry 1987, Collon a Budding 1988), skleníkový test na kompaktních rostlinách (Stewart a kol. 1983) a laboratorní testy na oddělených listech (Lapwood 1961, Vleeshouwers a kol. 1999), na lístcích (Malcolmson 1969) nebo listových discích (Hodkson 1961). Na rozdíl od laboratorních testů polní test může být uskutečněn jen během vegetační sezóny. Díky tomu jsou laboratorní testy oblíbené.
Test na Petriho miskách je laboratorním testem na oddělených lístcích. Byl vyvinut pro hodnocení somatických hybridů. Jeho výpovědní hodnota byla srovnávána s laboratorním testem na oddělených listech podle Vleeshouwers a kol. (1999). Test na Petriho misce velmi dobře koreluje s laboratorním testem podle Vleeshouwers a kol. (1999), kteří jejich test charakterizují jako dobrou alternativu k polnímu hodnocení.
Shrnutí: Cílem testu rezistence k P. infestans na Petriho misce je spolehlivě a operativně otestovat šlechtitelský materiál a urychlit jeho selekci.
2 Vlastní popis metodiky
Předkládaný metodický postup testu rezistence k P. infestans na Petriho miscevyžaduje rostlinný materiál v dobré zdravotní kondici bez přítomnosti škůdců a patogenů, s dobře vyvinutými listy tj. ve stáří asi 6 - 8 týdnů. Vlastní metodika má tedy pět nedílných částí.
- Kultivace rostlin
- Příprava Petriho misek
- Příprava sporové suspenze
- Odběr listů a založení pokusu
- Hodnocení
2.1 Kultivace rostlin
Pro test zajistíme pět rostlin na posuzovaný genotyp (s výjimkou semenáčů, pokud nebudou vysety do in vitro podmínek a naklonovány). Současně s hodnoceným materiálem napěstujeme kontroly – pozitivní (např. Asterix, Lukava) a negativní (např. Blaník, Inovátor, Kuras). Pro pěstování ve skleníku používáme směs rašeliny, zeminy a perlitu v poměru 3:3:1. Pro zajištění nepoškozených listů rostliny vyvazujeme.
In vitro rostliny
In vitro rostliny pěstujeme v klimatizační komoře s fotoperiodou 16 h/8 h světlo/tma (světelné podmínky: zářivky s typem světla – „daylight“a intenzitou 60 µmol m-2 s-1) při 22 °C. Rostliny kultivujeme na MS mediu bez hormonů (Murashige a Skoog 1962). Po šesti týdnech přesadíme rostliny do květníků (7 cm) a aklimatizujeme je (Polzerová a Greplová2009). Do zakořenění rostliny ve skleníku udržujeme 1 – 2 týdny zakryté transparentními kontejnery s průduchy. Ideální však je rostliny aklimatizovat v řízených podmínkách tj. fotoperiodě 16 h/8 h světlo/tma, intenzita 60 µmol m-2 s-1, 22 °C, 90% vlhkost. Po zakořenění rostliny převedeme do nádob (4 l zeminy) a dále pěstujeme ve skleníku standardním způsobem.
Semenáčky
Semena vysejeme do mělké misky do řádků, po vyklíčení (4 týdny) rostlinky (2 – 3 cm) přesazujeme do květníků (10 cm). Asi za 4 týdny, kdy je dobře vyvinutý kořenový systém, převedeme semenáče do nádob (4 l zeminy) a dále pěstujeme ve skleníku standardním způsobem.
Chceme-li získat pět identických rostlin provedeme výsev semen do in vitro podmínek. Pracujeme v laminárním boxu za aseptických podmínek. Semena povrchově sterilizujeme v 2% roztoku Chloraminu BS (Bochemie, ČR) po dobu 15 minut. Pro lepší smáčivost je vhodné do sterilizačního roztoku přikápnout smáčedlo (např. kuchyňský prostředek na mytí nádobí). Roztok slijeme přes husté vysterilizované sítko. Semena propláchneme sterilní destilovanou vodou a poté je ponoříme na 1 minutu do 70% etanolu. Etanol slijeme přes čisté vysterilizované sítko a důkladně propláchneme sterilní destilovanou vodou. Semena pak sterilní pinzetou klademe do zkumavek na povrch MS média. Kultivujeme za podmínek viz: In vitro rostliny.
Hlízy
Pět hlíz od každého genotypu vysadíme do 4 l nádob a dále pěstujeme ve skleníku standardním způsobem.
2.2 Příprava Petriho misek
Petriho misky (10 cm) vyplníme buničitou vatou a těsně před zahájením pokusu necháme nasáknout destilovanou vodou (38 ml).
2.3 Příprava sporové suspenze
Izolát P. infestans objednáme na specializovaném pracovišti (např. ČZU v Praze, Katedra ochrany rostlin). Kulturu P. infestans můžeme udržovat podle protokolu Vleeshouwers a kol. (1999). P. infestans přeočkujeme na žitné agarové médium doplněné 20 g/l sacharózy (Caten a Jinks 1968) a inkubujeme při 18 oC ve tmě. Po několika dnech pasážujeme na čerstvé médium. Agarová plotna je po týdnu porostlá sporulujícím myceliem.
Ke sporulujícímu myceliu přidáme studenou sterilní destilovanou vodu (4°C). Krouživým pohybem miskou zajistíme smočení mycelia. Asi po 10 minutách pipetou odsajeme suspenzi sporangiospor do sterilních uzavíratelných sklenic (100 ml) a inkubujeme při 4 °C 1 – 2 hodiny za účelem uvolnění zoospor. Pak provedeme filtraci sporové suspenze přes nylonové sítko (50 µm). Koncentraci zoospor pro inokulaci upravíme na 5 × 104 ml-1.
2.3.1 Určení hustoty zoospor pomocí Bürkerovy komůrky
Zhotovíme preparát, počítáme zoospory v pěti 3× orámovaných čtvercích (tj. čtverce o straně 1 mm), vlevo a nahoře počítáme všechny zoospory dotýkající se střední linky, vpravo a dole tyto nepočítáme. Stanovíme průměrný počet zoospor z pěti čtverců, což odpovídá hodnotě „X“. Koncentrace zoospor v 1 ml pak je: „X“ × 104 (1 čtverec reprezentuje objem 0,1 mm3 tj. 10-4 cm3 [1 cm3 = 1 ml]).
Celkový počet zoospor v suspenzi = Vsuspenze × „X“ × 104
Faktor ředění Fř = požadovaná hustota / „X“ × 104
Výsledný objem suspense v požadované hustotě = Vsuspenze / Fř
2.4 Odběr listů a založení pokusu
Od každého genotypu testujeme pět rostlin. Odebereme jeden plně vyvinutý složený list z každé rostliny (3. – 5. od vzrostného vrcholu). U semenáčů, protože se jedná o individuum, odebereme z každé rostliny pět plně vyvinutých složených listů, pokud nebyly semenáče naklonovány v in vitro.
Na připravené Petriho misky položíme pět vlhkých lístků oddělených z jednoho složeného listu spodní stranou na buničitou vatu.

Obr. Příklad uspořádání experimentu
Pod každý lístek napipetujeme 20µl sporové suspense. Takto připravíme pět misek na genotyp. Petriho misky kultivujeme pět dní při 18 – 20 oC, relativní vlhkosti 70 – 80 %, fotoperiodě 16/8 h a intenzitě světla 15 µmol m-2 s-1. První den udržujeme misky zakryté.
2. 5 Hodnocení
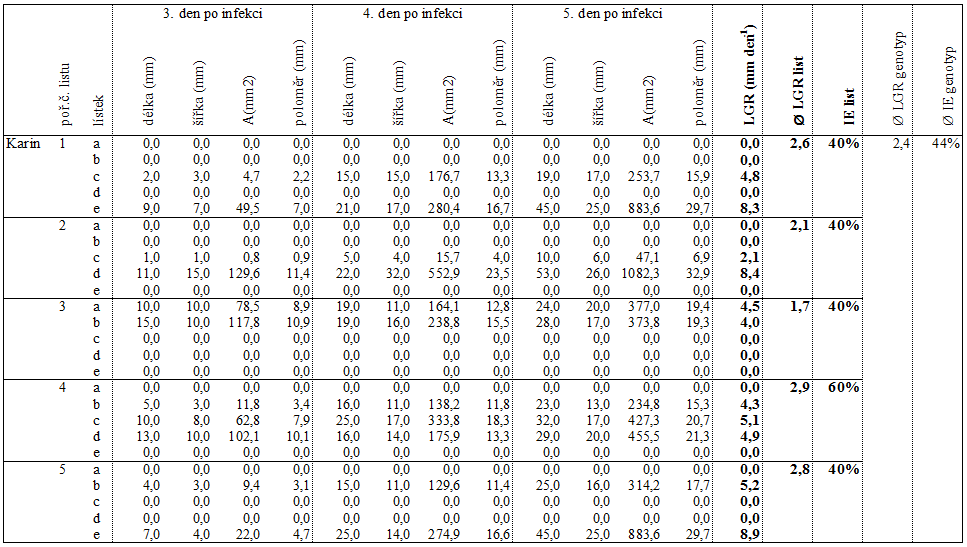
Léze měříme pomocí posuvného měřítka třetí, čtvrtý a pátý den od zahájení pokusu. U každé léze měříme největší délku a šířku a spočítáme plochu dle vztahu: A = ¼ × π × délka × šířka. Pokud je v rámci jednoho lístku pozorováno více lézí, je plocha „A“ spočítána jako suma ploch pozorovaných lézí. Následně spočítáme poloměr lézí odmocněním plochy A.
Pro statistické hodnocení je nutné spočítat hodnotu LGR (lesion growth rate; mm den-1) a efektivnost infekce (IE, %). Hodnota LGR vyjadřuje růst léze v čase a je získána lineární regresí v čase. Hodnota IE vyjadřuje procento úspěšnosti inokulace, tj. procento lístků s rostoucí lézí k celkovému počtu lístků na list resp. na rostlinu (rostoucí léze je taková léze jejíž plocha alespoň v jednom časovém úseku přesahuje plochu 16 mm2). Statistické hodnocení provádíme analýzou rozptylu, tj. ANOVA a Tukeyova metoda.
2.5.1 Příklad hodnocení
V následujícím příkladu hodnocení rezistence k P. infestans je zaznamenána teoretická situace, kdy na lístcích je pozorována maximálně jedna léze nebo známky infekce nejsou vůbec zaznamenány.
2.6 Použité roztoky, média a jejich příprava
- Murashige & Skoog médium
MS (Duchefa Biochemie) 4,4 g
sacharóza 30 g
agar 8 g
MS a sacharózu rozpustíme v 450 ml destilované vody, upravíme pH na 5,6 – 5,8 a doplníme na objem 500 ml destilovanou vodou. Agar rozpustíme v 400 ml destilované vody a rozvaříme v mikrovlnné troubě nebo ve vodní lázni, doplníme na konečný objem (500 ml). Oba roztoky spojíme a promícháme a rozlijeme do kultivačních nádob (do výšky 1 – 2 cm) a zavíčkujeme. Nádoby s médiem sterilizujeme autoklávováním při 121 oC 20 min.
- Roztok Chloramin BS 2%
Chloramin BS 2 g
smáčedlo 100 µl
Chloramin rozpustíme v 80 ml vody, přidáme smáčedlo a doplníme na 100 ml.
- Žitné agarové médium (Caten a Jinks 1968)
žito 60 g
sacharóza 20 g
agar 15 g
Žito namočíme do 500 ml destilované vody a ponecháme 36 hodin při pokojové teplotě (proces můžeme v případě nutnosti zkrátit povařením 1 hodinu na mírném ohni). Supernatant (I) slijeme a ponecháme k dalšímu použití. Nabobtnalá zrna macerujeme a luhujeme v 300 ml destilované vody při 50 oC 3 hodiny. Hmotu filtrujeme přes husté jemné plátno. Supernatant (II) ponecháme, sediment vyhodíme. Supernatant (I) doplníme agarem a rozvaříme v mikrovlnné troubě nebo ve vodní lázni. Supernatant (II) doplníme sacharózou. Oba roztoky spojíme a doplníme na 1000 ml destilovanou vodou. Sterilizujeme při 121 oC 15 minut. Žitné agarové médium rozléváme sterilně v laminárním boxu do sterilních Petriho misek a zajistíme parafilmem.
3 Seznam použité související literatury
- Agrios G (1997) Plant pathology, 4th edn. Academic Press. San Diego
- Caten CE, Jinks JL (1968) Spontaneous variability of single isolates of Phytophthora infestans I. Cultural variation. Canadian Journal of Botany 46: 329-347
- Chen Q, Kawchuk LM, Lynch DR, Goettel MS, Fujimoto DK (2003) Identification of late blight, Colarado potato beetle, and blackleg resistance in three mexican and two south american wild 2x (1EBN) Solanum species. Am J Pot Res 80(1): 9-19
- Collon LT, Budding DJ(1988) Resistance to late blight (Phytophthora infestans) in ten wild Solanum species. Euphytica Supplement: 77-86
- Fry WE (1987) Quantification of general resistance of potato cultivars and fungicide effects for integrated control of potato late blight. Phytopathology 68: 1650-1655
- Helgeson JP, Pohlman JD, Austin S, Haberlach GT, Wielgus SM, Ronis D, Zambolim L, Tooley P, McGrath JM, James RV, Stevenson WR (1998) Somatic hybrids between Solanum bulbocastanum and potato: a new source of resistance to late blight. Theor. Appl. Genet. 96: 738-742
- Hodkson W (1961) Laboratory testing of the potato for partial resistance to Phytophthora infestans. Americal Potato Journal 38: 261-264
- Lapwood D (1961) Laboratory assessments of the susceptibility of potato haulm to blight (Phytophthora infestans). European Potato Journal 4: 117-127
- Malcolmson J (1969) Factors involved in resistance to blight (Phytophthora infestans (Mont.) de Bary) in potatoes and assessment of resistance using detached leaves. Annals of Applied Biology 64: 461-468
- Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiol Plant 15: 473-497
- Polzerová H, Greplová M (2009) Acclimatization of somatic hybrids and plantlets after chromosome doubling in Solanum genus. Acta Horticulturae (ISHS) 812: 337-342
- Ramon M, Hanneman RE(2002) Introgression of resistance to late blight (Phytophthora infestans) from Solanum pinnatisectum into S. tuberosum using embryo rescue and double pollination. Euphytica 127: 421-435
- Rauscher GM, Smart CD, Simko I, Bonierbale M, Mayton H, Greenland A, Fry WE (2006) Characterization and mapping of Rpi-ber, a novel potato late blight resistance gene from Solanum berthaultii. Theor Appl Genet 112: 674-687
- Sandbrink JM, Colon LT, Wolters PJCC, Stiekama WJ (2000) Two related genotypes of Solanum microdontum carry different segregating alleles for field resistance to Phytophthora infestans. Mol Breed 6: 215-225
- Shaner G, Finney RE(1977) The effect of nitrogen fertilization on the expression of slow-mildewing resistance in Knox wheat. Phytopathology 67: 1051-1056
- Smilde WD, Brigneti G, Jagger L, Perkins S, Jones JDG(2005): Solanum mochiquense chromosome IX carries a novel late blight resistance gene Rpi-moc1. Theor Appl Genet 110: 252-258
- Stewart HE, Flavelle PH, McCalmont DC, Wastie RL (1983) Correlation between glasshouse and field test for resistance to foliage blight caused by Phytophthora infestans. Potato Research 26: 41-48
- Szczerbakowa A, Boltowicz D, Lebecka R, Radomski P, Wielgat B (2005) Characteristics of the interspecific somatic hybrids Solanum pinnatisectum (+) S. tuberosum H-8105. Acta Physiol Plant (27) 3a: 265-273
- Szczerbakova A, Boltowicz D, Wielgat B(2003) Interspecific somatic hybrids Solanum bulbocastanum (+) S. tuberosum H-8105. Acta Physiol Plant 25/4: 365-373
- Villamon FG, Spooner DM, Orrillo M, Mihovilovich E, Perez W, Bonierbale M(2005) Late blight resistance linkages in a novel cross of the wild potato species Solanum paucissectum (series Piurana). Theor Appl Genet 111: 1201-1214
- Vleeshouwers VGAA, van Dooijeweert W, Keizer LCP, Sijpkes L, Govers F, Colon LT (1999) A laboratory assay for Phytophthora infestans resistance in various Solanum species reflects the fiels situation. European Journal of Planat Pathology 105: 241-250
- Wang M, Allefs S, van den Berg RG, Vleeshauwers VGAA, van der Vossen EAG, Vosman B (2008) Allele mining in Solanum: conserved homolugues of Rpi-blb1 are identified in Solanum stoloniferum. Theor Appl Genet 116: 933-943
Poděkování
Autoři děkují oponentům Mgr. Jiřině Procházkové, Ph.D. a Ing. Václavu Čermákovi za pročtení metodiky a cenné připomínky.
Metodika byla naplánována a je uplatněna a ověřena při řešení MSM 6010980701 „Molekulární a technologické základy produkce kvalitních brambor“.