Autorský kolektiv:
Ing. Marie Greplová,
Eliška Greplová,
Mgr. Hana Polzerová,
Ing. Jaroslava Domkářová, Ph.D., MBA
1 Cíl metodiky
Využití zdrojů rezistence klasickými šlechtitelskými postupy je silně limitováno. Tato skutečnost dává příležitost moderním biotechnologickým metodám, jakými jsou symetrická a asymetrická somatická hybridizace. Somatická hybridizace může překonat sexuální inkompatibilitu a poskytnout nové šlechtitelské materiály (Davey a kol. 2005). Symetrická somatická hybridizace rovnocenně kombinuje jaderný i mimojaderný genom, což je spojeno s větším výskytem nežádoucích vlastností planého druhu v nově získaném šlechtitelském materiálu. Asymetrická somatická hybridizace tento problém částečně řeší eliminací jaderného genomu planého rodiče tedy donora (Xia a kol. 2003, Liu a kol. 2005). Eliminace je prováděna pomocí záření (X, γ nebo UV), které způsobuje nevratné zlomy nebo fragmentaci chromozomů. Takovéto poškození zajišťuje omezení vlivu jaderné genetické informace donora (Zubko a kol. 2002, Jain a kol. 1988, Vlahová a kol. 1997).
Asymetrickou somatickou hybridizaci je možno provádět dvojím způsobem. Pokud je ošetřen jenom donor, pak fúzí neošetřených protoplastů a protoplastů s eliminovaným jádrem vzniká cytoplazmatický hybrid (cybrid) (Yarrow 1999, Guo a kol. 2004). Druhou cestou je ošetření donora i recipienta. Recipient (kulturní druh) je ošetřen metabolickými inhibitory jako jodooctovou kyselinou, jodoacetamidem nebo rhodaminem (Matibiri a Mantell 1994, Yarrow 1999, Polzerová a Greplová 2008). Ošetření donora současně s recipientem slouží jako efektivní selekce (Matibiri a Mantell 1994), protože pouze heterofúzované protoplasty přežívají díky komplementaci metabolismu (Liu a kol. 2005).
Získání asymetrických somatických hybridů je cenné zvláště tím, že umožňuje přenos žádoucích vlastností planého druhu a zároveň redukuje nutnost velkého počtu zpětných křížení (Fosberg a kol. 1998).
Shrnutí: Cílem asymetrické fúze protoplastů je umožnit přenos žádoucích genů, resp. vlastností z planých druhů rodu Solanum do kulturního Solanum tuberosum. Takový přenos není dosažitelný klasickými šlechtitelskými postupy. Asymetrická somatická hybridizace umožňuje omezit nežádoucí vliv jaderného genomu planého druhu, a získat tak nový šlechtitelský materiál přímo využitelný ve šlechtění.
2 Vlastní popis metodiky
Předkládaný metodický postup asymetrické fúze protoplastů elektrickým polem vyžaduje dostatek vhodného rostlinného materiálupro izolaci a ošetření protoplastů a po vlastní fúzi jejich kultivaci k dosažení regenerace rostlin. Vlastní metodika má tedy pět nedílných částí.
- Kultivace donorových rostlin
- Izolace protoplastů
- Ověření životnosti protoplastů a jejich ošetření
- Fúze protoplastů elektrickým polem
- Kultivace produktů fúze
2.1 Kultivace donorových rostlin
In vitro rostliny pěstujeme v klimatizační komoře s fotoperiodou 16 h/8 h světlo/tma (světelné podmínky: zářivky, typ světla – „daylight“, intenzita - 60 µmol m-2 s-1), při 22 °C. Rostliny kultivujeme na MS mediu bez hormonů (Murashige a Skoog 1962).
Rostliny určené pro izolaci protoplastů množíme na SH médiu bez hormonů (Schenk a Hildebrand 1972) obohaceném o AgNO3 a Alar 85 (succinic acid dimethylhydrazide) - 10 až 20 rostlin odkaždého rodičovského genotypu. Rostliny necháme růst po dobu 4 - 6 týdnů. Den před izolací vystavíme rostliny chladu (10 °C) a tmě po dobu 24 hodin. Tyto stresové podmínky umožní synchronizaci buněčného cyklu, což se pozitivně odrazí v následné regeneraci protoplastů.
2.2 Izolace protoplastů
Celý proces izolace protoplastů probíhá ve sterilním prostředí.
Odtrhneme listy (z 10 rostlin, 0,5 - 1 g), rozřežeme je na malé kousky ostrým skalpelem v jedné Petriho misce (Ø = 5 cm) obsahující 5 - 6 ml roztoku enzymu (Bříza a Machová 1991) a Petriho misku utěsníme Parafilmem.
Petriho misky inkubujeme ve tmě přes noc (14 – 16 h) v termostatu při 25 oC; po uplynutí této doby zhodnotíme stav rostlinné tkáně pod mikroskopem; v některých případech (v závislosti na genotypu) umístíme Petriho misky na třepačku asi na15 min.
Rostlinnou tkáň s enzymatickým roztokem přeneseme pomocí jednorázové pipety s otevřeným koncem na sítko (velikost pórů 75 μm) umístěné na Petriho misce (Ø = 5 cm) a za jemného míchání propláchneme sítko sterilním roztokem 0,5 M sacharózy. Tímto krokem oddělíme uvolněné protoplasty od zbytku rostlinné tkáně. Takto získanou suspenzi protoplastů rozdělíme do centrifugačních zkumavek (8 ml) a převrstvíme roztokem W5 (Menczel a kol. 1981) o objemu 1 ml.
Centrifugujeme 12 min při 700 rpm.
Pasteurovou pipetou opatrně odsajeme plující protoplasty tvořící prstýnek na rozhraní použitých roztoků a umístíme je do nové centrifugační zkumavky, přidáme potřebné množství W5 (5 ml) a resuspendujeme.
Centrifugujeme 6 min při 500 rpm.
Pasteurovou pipetou odstraníme supernatant, přidáme W5 (2 – 5 ml) a resuspendujeme pelet.
sCentrifugujeme 6 min při 500 rpm a Pasteurovou pipetou odstraníme supernatant.
Od protoplastů každého genotypu odebereme vzorek (5 μl)na určení životnosti (viz 2.3.1) a zbylé protoplasty rozdělíme do dvou zkumavek. Jeden vzorek (1/4 celkového objemu vyizolovaných protoplastů) bude sloužit vždy jako kontrola. Druhý vzorek bude ošetřen buď UV zářením (planý druh) nebo metabolickým inhibitorem (kulturní druh).
Ke kontrole přidáme kultivační médium SW11 (Bříza a Machová 1991), aby bylo dosaženo požadované hustoty 6×105/ml (viz 2.3.2).
2.3 Ověření životnosti, úprava hustoty a ošetření protoplastů
2.3.1 Vyhodnocení životnosti protoplastů před fúzí
20 μl ředěného FDA + 20 μl suspense protoplastů pipetujeme na podložní sklo, vytvoříme preparát. Po 4 - 5 minutách vyhodnotíme preparát pomocí fluorescenčního mikroskopu. Ve vybraném zorném poli bez UV světla spočteme protoplasty a následně zeleně svítící protoplasty v UV světle (zeleně svítící protoplasty jsou živé). Vypočteme procentní podíl životných protoplastů z celkového počtu protoplastů v zorném poli. Při životnosti nad 50 % je zkoumaná suspenze použitelná pro fúze.
2.3.2 Určení hustoty protoplastů pomocí Bürkerovy komůrky
Určení hustoty protoplastů před fúzí (před kultivací) probíhá ve sterilním prostředí.
K naizolovaným protoplastům přidáme Pasteurovou pipetou přiměřené množství (2 – 4 ml) předfúzního roztoku (Schilde-Renschler a Ninneman 1988), resuspendujeme (v tomto roztoku mohou protoplasty pobývat až 2 hodiny v lednici při 6 – 7 oC) a určíme hustotu protoplastů pomocí Bürkerovy komůrky.
Zhotovíme preparát, počítáme protoplasty v pěti 3× orámovaných čtvercích (tj. čtverce o straně 1 mm), vlevo a nahoře počítáme všechny buňky dotýkající se střední linky, vpravo a dole tyto nepočítáme. Stanovíme průměrný počet protoplastů z pěti čtverců, což odpovídá hodnotě „X“. Koncentrace buněk v 1 ml pak je: „X“ × 104 (1 čtverec reprezentuje objem 0,1 mm3 tj. 10-4 cm3 [1 cm3 = 1 ml]).
Celkový počet protoplastů z hmoty listů = Vsuspenze × „X“ × 104
Faktor ředění Fř = požadovaná hustota / „X“ × 104
Výsledný objem suspense v požadované hustotě = Vsuspenze / Fř
Následně podle potřeby upravíme koncentraci pro fúze (viz 2.4.1) nebo kultivace protoplastů.
2.3.3 Ošetření protoplastů UV zářením
Aplikaci UV záření provádí proškolená osoba, která je vybavena ochrannými prostředky (plášť s dlouhými rukávy, odolné nitrilové rukavice, laboratorní kalhoty a laboratorní obuv).
Při práci je nezbytné dodržet všechna bezpečnostní opatření dle platných předpisů.
Ošetření protoplastů UV zářením probíhá ve sterilním prostředí.
K naizolovaným protoplastům přidáme Pasteurovou pipetou přiměřené množství (2 – 4 ml) předfúzního roztoku (Schilde-Renschler a Ninneman 1988), resuspendujeme (v tomto roztoku mohou protoplasty pobývat až 2 hodiny v lednici při 6 – 7 oC) a ozáříme zářením UV-C s vlnovou délkou 240 nm v dávce 370 µW cm-2 po dobu 10 minut. Podmínky ozáření vypočteme podle vztahu:
E = I × cosα / r2 [W / m2]
I je zářivost daná vztahem: I = P / 4π [W / st]
P je výkon zdroje [W], r je kolmá vzdálenost od zdroje k ozařované ploše [m] a α je úhel od kolmice.
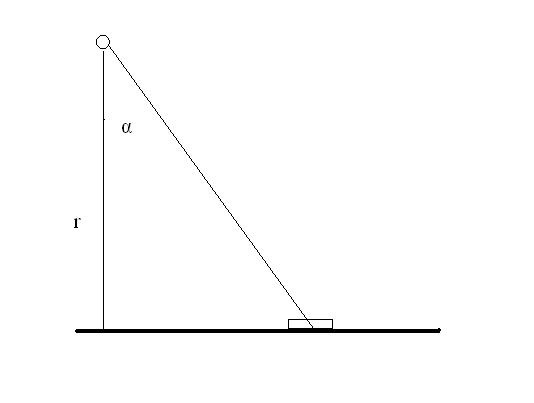
Obr. Schéma uspořádání experimentu
Určíme hustotu protoplastů podle bodu 2.3.2. Odebereme ¼ vzorku a pomocí SW11 upravíme na požadovanou hustotu a dáme kultivovat. U zbývajícího vzorku pokračujeme podle bodu 2.4.1
2.3.4 Ošetření protoplastů metabolickými inhibitory
Aplikaci metabolických inhibitorů provádí proškolená osoba, která je vybavena ochrannými prostředky (celoobličejová maska s ventilací přes filtry, plášť s dlouhými rukávy, odolné nitrilové rukavice, laboratorní kalhoty a laboratorní obuv).
Při práci je nezbytné dodržet všechna bezpečnostní opatření dle platných předpisů.
Ošetření protoplastů metabolickými inhibitory probíhá ve sterilním prostředí.
K naizolovaným protoplastům přidáme roztkok metabolického inhibitoru (na 1 ml suspenze 5 ml roztoku).
Směs protoplastů jemně promícháme Pasterurovou pipetou. Účinnou látku necháme působit 30 minut. Centrifugujeme 6 min při 500 rpm.Pasteurovou pipetou odstraníme supernatant, přidáme W5 (8 - 9 ml) a resuspendujeme pelet.Centrifugujeme 6 min při 500 rpm a Pasteurovou pipetou odstraníme supernatant a celý proces promývání v roztoku W5 opakujeme.Centrifugujeme 6 min při 500 rpm, odstraníme supernatant, odebereme ¼ vzorku a pomocí SW11 upravíme na požadovanou hustotu a dáme kultivovat. U zbývajícího vzorku pokračujeme podle bodu 2.3.2.
2.4 Fúze protoplastů elektrickým polem
2.4.1 Úprava koncentrace protoplastů před fúzí
Centrifugujeme 3 min při 500 rpm a Pasteurovou pipetou odstraníme supernatant. Celý proces fúze protoplastů probíhá ve sterilním prostředí.
Pasteurovou pipetou přidáme fúzní roztok (Schilde-Renschler a Ninneman 1988), aby byla dosažena požadovaná koncentrace protoplastů pro fúzi 6×105/ml a protoplasty resuspendujeme.
Smícháme suspenze protoplastů dvou fúzních partnerů (UV ozářené a ošetřené metabolickým inhibitorem) v poměru 1:1.
2.4.2 Fúze protoplastů
Fúze protoplastů je uskutečněna pomocí elektroporátoru (ECM 2001, BTX, Inc., San Diego, CA) a příslušenství (mikroskop, držák na fúzní komůrky, fúzní komůrky). Mikroskop umístíme do flow-boxu, před fúzí vysterilizujeme komůrky 70% alkoholem a necháme vyschnout. Po vyschnutí naneseme Pasteurovou pipetou 20 - 30 μl suspenze protoplastů do elektroporační komůrky, umístíme do držáku, celý proces fúze sledujeme v invertním mikroskopu.
Proces fúze protoplastů: protoplasty se nechají seřadit za působení střídavého proudu (AC field), poté je aplikován puls stejnosměrného proudu (DC pulse), který vede k fúzi.
Základní parametry elektrického pole
AC 5 V/komora se vzdáleností elektrod 0,5 mm 2 – 18s
DC puls 10 V/ komora se vzdáleností elektrod 0,5 mm 80 μs
AC 30 V/komora se vzdáleností elektrod 3,2 mm 2 – 18s
DC puls 60 V/ komora se vzdáleností elektrod 3,2 mm 80 μs
Po fúzi umístíme protoplasty z pěti komůrek Pasteurovou pipetou do jedné Petriho misky (Ø = 3,5 cm), k suspenzi protoplastů přidáme 1 ml kultivačního média (tekuté SW11, Bříza a Machová 1991). Petriho misky zatěsníme Parafilmem, přemístíme je do termostatu a kultivujeme ve tmě při 25 oC. Další kultivace dle protokolu kultivace produktů fúze protoplastů.
2.5 Kultivace produktů fúze protoplastů
Celý proces kultivace produktů fúze probíhá ve sterilním prostředí.
První buněčné dělení se obvykle uskuteční 2 – 3 dny po fúzi (ověříme pod mikroskopem), po vytvoření buněčné stěny přidáváme v intervalu 7 – 10 dní tekuté médium SW11 se snižující se hladinou osmotika až do stádia mikrokalusů (tj. postupně SW11 0,5M manitol, SW11 0,4 M manitol, SW11 0,3M manitol, Bříza a Machová 1991). Po vytvoření buněčné stěny možno kultivovat na světle (16 h fotoperioda/ 22 oC; světelné podmínky: fluorescenční zářivky – „daylight“, 150 µmol m-2 s-1).
Mikrokalusy se formují 3 – 4 týdny po fúzi, jsou-li již viditelné - provádí se výměna média. Médium SW11 odsajeme a nahradíme tekutým médiem Shepard C (Shepard a Totten 1977). Po 7 – 10 dnech výměnu 2x opakujeme.
Následně sterilně přeneseme kalusy do čistých Petriho misek. Kalusy kultivujeme v tekutém nebo agarem zpevněném médiu Shepard D (Shepard a Totten 1977) nebo modifikovaném médiu Shepard D – SG2 , výměnu média provádíme po 10 – 14 dnech až do regenerace stonků.
Regeneranty kultivujeme za stejných podmínek jako donorové rostliny pro izolaci protoplastů. Rostliny množíme do dvojic k následnému testování hybridity.
2.6 Použité roztoky, média a jejich příprava
2.6.1
- Murashige & Skoog médium
MS (Duchefa Biochemie) 4,4 g
sacharóza 30 g
agar 8 g
MS a sacharózu rozpustíme v 490 ml destilované vody, upravíme pH na 5,6 – 5,8 a doplníme na objem 500 ml destilovanou vodou. Agar rozpustíme v 400 ml destilované vody a rozvaříme v mikrovlnné troubě nebo ve vodní lázni, doplníme na konečný objem (500 ml). Oba roztoky spojíme a promícháme a rozlijeme do kultivačních nádob (do výšky 1 – 2 cm) a zavíčkujeme. Nádoby s médiem sterilizujeme autoklávováním při 121 oC 20 min.
- Schenk & Hildebrand médium
SH médium (Duchefa Biochemie) 3,2 g
Vitamíny SH (Duchefa Biochemie) 1,01 g
sacharóza 15 g
AgNO3 0,003 g
Alar 0,0015 g
Agar 8 g
Kromě agaru vše rozpustíme v 490 ml destilované vody, upravíme pH na 5,6 – 5,8 a doplníme na objem 500 ml destilovanou vodou. Agar rozpustíme v 400 ml destilované vody a rozvaříme v mikrovlnné troubě nebo ve vodní lázni, doplníme na konečný objem (500 ml). Oba roztoky spojíme a promícháme a rozlijeme do kultivačních nádob (do výšky 1 – 2 cm) a zavíčkujeme. Nádoby s médiem sterilizujeme autoklávováním při 114 oC 20 min.
2.6.2
- Enzymatický roztok
Zásobní roztok:
CaCl2.2 H2O 0,735 g
MES 1,952 g
Sacharóza 171,15 g
NAA 0,005 g (zásobní roztok 100 mg/100 ml, sterilizace filtrací)
ZT 0,002 g (zásobní roztok 50 mg/100 ml, sterilizace filtrací)
Navážku bez růstových regulátorů rozpustíme v 480 ml destilované vody, upravíme pH na 5,6 – 5,8. Zásobní roztok sterilizujeme v autoklávu při 121 °C 20 min. Po sterilizaci přidáme růstové regulátory a doplníme sterilní destilovanou vodou na 500 ml. Rozdělíme po 50 ml do uzavíratelných nádob. Roztok je možné zamrazit na – 20 oC. [ZT = zeatin; NAA = alpha-naphthylenacetic acid; MES = 2 – (N- morpholino)ethanesulfonic acid].
Příprava enzymů:
Celuláza Onozuka R-10 (Duchefa Biochemie) 1 g (respektive 1 U)
Macerozym R-10 (Duchefa Biochemie) 0,2 g (respektive 0,2 U)
Navážku rozpustíme, upravíme pH na 5,6 – 5,8 a doplníme do 50 ml destilovanou vodou a sterilizujeme filtrací. Případně navážku přepočteme podle „U“ jednotek uvedených na etiketě konkrétního balení enzymu.
Pracovní roztok enzymů:
50 ml enzymů smícháme ve sterilních podmínkách s 50 ml zásobního roztoku (případný přebytek pro uchování zamrazíme na – 20 oC až na 1 měsíc).
- 0,5 M sacharóza
Sacharóza 171,15 g
rozpustíme v destilované vodě na konečný objem 1000 ml, sterilizujeme v autoklávu při 121 °C 20 min, uchováváme v chladu při 6 – 7 oC.
- Roztok W5
NaCl 9,0 g
KCl 0,8 g
CaCl2.2 H2O 18,4 g
Glukóza 1,0 g
Glycin 1,0 g
rozpustíme v 900 ml destilované vody, upravíme pH na 5,8 a doplníme destilovanou vodou na 1000 ml. Sterilizujeme v autoklávu při 121 °C 20 min, uchováváme v chladu při 6 – 7 oC.
Koncentrovaný roztok W5: navážku rozpustíme v 400 ml destilované vody, upravíme pH na 5,8 a doplníme destilovanou vodou na 500 ml. Sterilizujeme v autoklávu při 121 °C 20 min, uchováváme v chladu při 6 – 7 oC.
2.6.3
- Roztok FDA (fluoresceindiacetát)
FDA 0,005 g
Zásobní roztok připravíme rozpuštěním navážky v 1 ml acetonu. Pracovní roztok: 20 μl zásobního roztoku přidáme do 1 ml kultivačního roztoku, sacharózy nebo W5.
- Roztoky metabolicky účinných látek
Přípravu roztoků metabolicky účinných látek provádí proškolená osoba, která je vybavena ochrannými prostředky (celoobličejová maska s ventilací přes filtry, plášť s dlouhými rukávy, odolné nitrilové rukavice, laboratorní kalhoty a laboratorní obuv).
Jodooctová kyselina 0,0186 g
Zásobní roztok připravíme rozpuštěním navážky v 10 ml destilované vody. Sterilizujeme filtrací (0,22 µm).
Pracovní roztok připravíme smícháním 200 μl zásobního roztoku účinné látky s 5 ml koncentrovaného roztoku W5 a doplníme na 10 ml sterilní destilovanou vodou.
Jodoacetamid 0,0185 g
Zásobní roztok připravíme rozpuštěním navážky v 10 ml destilované vody. Sterilizujeme filtrací (0,22 µm).
Pracovní roztok připravíme smícháním 400 μl zásobního roztoku účinné látky s 5 ml koncentrovaného roztoku W5 a doplníme na 10 ml sterilní destilovanou vodou.
2.6.4
- Předfúzní roztok
Manitol 7,4 g
CaCl2. 2H2O 0,011 g
rozpustíme v 90 ml destilované vody, upravíme pH na 5,6 a doplníme destilovanou vodou na 100 ml. Sterilizujeme autoklávováním při 121 oC 20 min.
- Fúzní roztok
Manitol 7,4 g
rozpustíme v 90 ml destilované vody, upravíme pH na 5,6 a doplníme destilovanou vodou na 100 ml. Sterilizujeme autoklávováním při 121 oC 20 min.
2.6.5
|
|
SW11
|
SW11 (0,4M)
|
SW11 (0,3M)
|
SW11 (0,2M)
|
|
|
|
|
|
|
|
KNO3
|
950 mg
|
|
|
|
|
CaCl2.2 H2O
|
367,5 mg
|
|
|
|
|
MgSO4. 2 H2O
|
185 mg
|
|
|
|
|
KH2PO4
|
85 mg
|
|
|
|
|
NH4Cl
|
133 mg
|
|
|
|
|
Myo-inositol
|
100 mg
|
|
|
|
|
Casein hydrolysate
|
500 mg
|
|
|
|
|
L-glutamin
|
100 mg
|
|
|
|
|
Yeast extract
|
100 mg
|
|
|
|
|
Sacharóza (0,01M)
|
3423 mg
|
|
|
|
|
manitol
|
89,2682 g
|
72,87 g
|
54,65 g
|
36,44 g
|
|
|
|
|
|
|
|
Thiamine. HCl
|
10 mg
|
připravíme zásobní roztoky (100 ml) o koncentraci 1 mg/1 ml
|
|
Pyridoxine. HCl
|
1 mg
|
|
|
|
Nicotinic acid
|
1 mg
|
|
|
|
|
H3BO3
|
3 mg
|
(a do média pipetujeme příslušné množství, např. Thiamine. HCl 10 ml)
|
|
MnSO4. 4H2O
|
14 mg
|
|
|
ZnSO4. 7H2O
|
2 mg
|
|
|
|
|
CuSO4.5H2O
|
0,025 mg
|
|
|
|
|
KI
|
0,75 mg
|
|
|
|
|
Na2MoO4. 2H2O
|
0,25 mg
|
|
|
|
|
CoCl2. 6H2O
|
0,025 mg
|
|
|
|
|
FeSO4. 7H2O
|
13,9 mg
|
|
|
|
|
Na2EDTA.2H2O Chelaton III
|
37,3 mg
|
|
|
|
|
|
|
|
|
|
|
NAA
|
2 mg*
|
|
|
|
|
2,4 D
|
0,2 mg
|
|
|
|
|
Zeatin
|
0,5 mg*
|
|
|
|
rozpustíme v 900 ml destilované vody, upravíme pH na 5,6 – 5,8 a sterilizujeme v autoklávu při 121 °C 20 min. Sterilně přidáme Zeatin a NAA a doplníme sterilizovanou destilovanou vodou na 1000 ml, uchováváme v chladu při 6 – 7 oC.
* Zeatin - zásobní roztok 50 mg/100 ml sterilizujeme filtrací. NAA - zásobní roztok 100 mg/100 ml sterilizujeme filtrací.
- Médium Shepard C a Shepard D
|
|
C0,3M
|
C0,2M
|
D0,2M
|
SG2
|
|
|
NH4 NO3
|
|
|
1650 mg
|
|
|
KNO3
|
1900 mg
|
|
1900 mg
|
|
|
CaCl2.2 H2O
|
440 mg
|
|
440 mg
|
|
|
MgSO4. 7 H2O
|
370 mg
|
|
370 mg
|
|
|
KH2PO4
|
170 mg
|
|
170 mg
|
|
|
Na2EDTA
|
37,3 mg
|
|
37,3 mg
|
|
|
FeSO4. 7H2O
|
27,8 mg
|
|
27,8 mg
|
|
|
H3BO3
|
6,2 mg
|
|
6,2 mg
|
připravíme zásobní roztoky (100 ml)
|
|
MnCl2. 4H2O
|
19,8 mg
|
|
19,8 mg
|
o koncentraci 1 mg/1 ml
|
|
ZnSO4. 7H2O
|
9,2 mg
|
|
9,2 mg
|
|
|
KI
|
0,83 mg
|
|
0,83 mg
|
(a do média pipetujeme příslušné
|
|
Na2MoO4. 2H2O
|
0,25 mg
|
|
0,25 mg
|
množství, např. H3BO3 6,2 ml)
|
|
CuSO4. 5H2O
|
0,025 mg
|
|
0,025 mg
|
|
|
CoSO4.7H2O
|
0,03 mg
|
|
0,03 mg
|
|
|
Myo-inositol
|
100 mg
|
|
100 mg
|
|
|
Thiamin. HCl
|
0,5 mg
|
|
0,5 mg
|
|
|
Glycin
|
2 mg
|
|
2 mg
|
|
|
Nicotinic acid
|
5 mg
|
|
5 mg
|
|
|
Pyridoxine. HCl
|
0,5 mg
|
|
0,5 mg
|
|
|
Folic acid
|
0,5 mg
|
|
0,5 mg
|
|
|
Biotin
|
0,05 mg
|
|
0,05 mg
|
|
|
Casein hydrolyzate
|
1000 mg
|
|
1000 mg
|
|
|
Adenin sulfát
|
40 mg
|
|
40 mg
|
|
|
NAA
|
0,05 mg*
|
|
|
|
|
IAA
|
|
|
0,1 mg*
|
0 mg
|
|
|
BAP (6-benzylaminopurin)
|
0,5 mg*
|
|
|
2,25 mg*
|
|
|
Zeatin
|
|
|
0,5 mg*
|
4 mg*
|
|
|
Manitol
|
54,654 g
|
36,44 g
|
36,44 g
|
|
|
Sacharóza 15 mM
|
5,1345 g
|
|
5,1345 g
|
|
|
MES
|
0,976 g
|
|
0,976 g
|
|
|
|
Agar (zpevněné médium)
|
|
|
7 g
|
|
| |
|
|
|
|
|
|
rozpustíme v 900 ml destilované vody, upravíme pH na 5,8 a sterilizujeme v autoklávu při 121 °C 20 min. Sterilně přidáme NAA, IAA, zeatin, BAP popř. kyselinu giberelovou (viz výše) a doplníme sterilizovanou destilovanou vodou na 1000 ml, uchováváme v chladu. Shepard D připravujeme buď tekuté médium nebo s agarem, agarem zpevněné médium rozléváme do Petriho misek ve flow-boxu.
* Zeatin - zásobní roztok 50 mg/100 ml sterilizujeme filtrací. NAA - zásobní roztok 100 mg/100 ml sterilizujeme filtrací. IAA - zásobní roztok 100 mg/100 ml sterilizujeme filtrací. BAP – zásobní roztok 50 mg/100 ml sterilizujeme filtrací.
2.7 Kontrola sterility použitých roztoků
Všechny roztoky před každým použitím zkontrolujeme bakteriálním testem: 1 ml roztoku + 1 ml provokačního média. Kultivujeme ve tmě při 25 oC po 3 – 4 dnech hodnotíme (přítomnost infekce je indikována mléčným zabarvením roztoku).
Provokační médium: Standard I nutrient broth for microbiology (Merck) – 25 g/l
2.8 Hodnocení regenerantů
Pro ověření ploidie doporučujeme použít průtokovou cytometrii (http://lmcc.ieb.cz/book/analysis-ploidy-level). Asymetrické somatické hybridy je vhodné ověřit některou z metod analýzy jaderné DNA např. RAPD (Greplová a kol. 2007) a analýzy mitochondriální a plastidové DNA (Bastia a kol. 2001, Harding a Millam 2000, Lössl a kol. 2000).
3 Seznam použité související literatury
- Bastia T, Scotti N, Cardi T (2001) Organelle DNA analysis of Solanum and Brassica somatic hybrids by PCR with ‘universal primers’. Theor Appl Genet 102:1265-1272
- Bříza J, Machová I (1991) Regeneration of plants from leaf mesophyll protoplasts of the tetraploid potato cultivars Xenia and Bintje. Biologia plantarum 33 (3): 225-233
- Davey MR, Anthony P, Power JB, Lowe KC (2005) Plant protoplast technology: Current status. Acta Physiologia Plantarum, 27: 117-129
- Fosberg J, Dixelius C, Lagercrants U, Glimelius K (1998) UV dose-dependent DNA elimination in asymmetric somatic hybrids between Brassica napus and Arabidopsis thaliana. Plant Sci., 131: 65-76
- GreplováM, PolzerováH, KreuzL (2007) Protoplast fusion by electric field at the model material S. tuberosum L. Scientific studies 15 – Potato Research Institute Havlíčkův Brod, 2007: 71-83
- Guo WW, Prasad D, Cheng YJ, Serrano P, Deng XX, Grosser JW (2004) Targeted cybridization in Citrus: transfer of Satsuma cytoplasm to seedy cultivars for potential seedlessness. Plant Cell Rep., 22: 752-758
- Harding K, Millam S (2000) Analysis of chromatin, nuclear DNA and organelle composition in somatic hybrids between Solanum tuberosum and Solanum sanctae-rosae. Theor Appl Genet 101:929-947
- Jain SM, Shahin EA, Sun S (1988) Interspecific protoplast fusion for the transfer atrazine resistance from Solanum nigrum to tomato (Lycopersicon esculentum L.). Plant Cell Tiss. Organ Cult., 12: 189-192
- Liu J, Xu S, Deng X (2005) Intergeneric somatic hybridization and its application to crop genetic improvement. Plant Cell Tiss. Organ Cult., 82: 19-44
- Lössl A, Götz M, Braun A, Wenzel G (2000) Molecular markers for cytoplasm in potato: male sterility and contribution of different plastid-mitochondrial configurations to starch production. Euphytica 116:221-230
- Matibiri EA, Mantell SH (1994: Cybridization in Nicotiana tabacum L. using double inactivation of parental protoplasts and post-fusion selection based on nuclear-encoded and chloroplast-encoded marker genes. Theor. Appl. Genet., 88(8): 1017-1022
- Menczel L, Nagy F, Kiss ZR, Maliga P (1981) Streptomycin resistant and sensitive somatic hybrids of Nicotiana tabacum + Nicotiana knightiana: correlation of resistance to N. tabacum plastids. Theor Appl Genet 59: 191-195
- Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiol Plant 15: 473-497
- Polzerová H, Greplová M (2008) Introduction to cybridization between Solanum verrucosum and Solanum tuberosum. Vědecké práce – Výzkumný ústav bramborářský, Havlíčkův Brod, 16: 65-75
- Schenk RU, Hildebrandt AC (1972) Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Can J Bot 50: 199-204
- Shepard FJ, Totten RE (1977) Messophyll cell protoplasts of potato. Plant Physiol 60: 313-316
- Simko I (2002) Comparative analysis of quantitative trait loci for foliage resistance to Phytophthora infestans in tuber-bearing Solanum species. Amer J Potato Res 79: 125-132
- Schilde-Renschler L, Ninnemann H (1988) Kombination von Kartoffellinien durch Protoplastenfusion zur Regeneration tetraploider züchterisch nutzbarer Hybidpflanzen. Vortr Pflanzenzüchtg 14: 149-163
- Vlahova M, Hinnisdaels S, Frulleux F, Claeys M, Atanassov A, Jacobs M (1997) UV irradiation as a tool for obtaining asymmetric somatic hybrids between Nicotiana plumbaginifolia and Lycopersicon esculentum. Theor. Appl. Genet., 94: 184-191
- Xia GM, Xiang FN, Zhou AF, Wang H, Chen HM (2003) Asymmetric somatic hybridization between wheat (Triticum aestivum L.) and Agropyron elongatum (Host) Neviski. Theor. Appl. Genet., 107: 299-305
- Yarrow S (1999) Production of Cybrids in Rapeseed (Brassica napus). In: Hall, R.D. (Ed.): Plant Cell Culture Protocols. Methods in Molecular Biology. Vol. 111. Springer: 211-224
- Zubko MK, Zubko EI, Gleba YY (2002) Self-fertile cybrids Nicotiana tabacum (+ Hyoscyamus aureus) with nucleo-plastome incompatibility. Theor. Appl. Genet. 105: 822-828
Poděkování
Autoři děkují oponentům RNDr. Pavlu Lízalovi, Ph.D. a Ing. Václavu Čermákovi za pročtení metodiky a cenné připomínky.
Metodika byla naplánována a je uplatněna a ověřena při řešení MSM 6010980701 „Molekulární a technologické základy produkce kvalitních brambor“.